Закон сохранения и превращения энергии и процесс электролиза
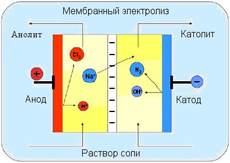 Электролиз — процесс без которого невозможно существование современной металлургии, химии и других отраслей. Для его осуществления необходимы растворы, в которых имеются ионы ( отрицательно и положительно заряженные частицы). Эти растворы называются электролитами. В раствор вводят два электрода и подают на них электрическое напряжение — на анод — положительное, на катод – отрицательное.
Электролиз — процесс без которого невозможно существование современной металлургии, химии и других отраслей. Для его осуществления необходимы растворы, в которых имеются ионы ( отрицательно и положительно заряженные частицы). Эти растворы называются электролитами. В раствор вводят два электрода и подают на них электрическое напряжение — на анод — положительное, на катод – отрицательное.
При прохождении тока через электролит (в растворах носителями зарядов являются ионы) происходят химические реакции на электродах, погружённых в него. При этом выделяются химические соединения входящие в состав электролита. Этот процесс и называется электролизом. Законы электролиза открыл Фарадей, который показал, что масса выделившегося в процессе электролиза вещества, зависит от силы тока, времени процесса, химического эквивалента и не зависит от напряжения на электродах.
Эта масса равна: m=I x t x k / F
где: m—масса выделившегося вещества;
I — сила тока;
t — время процесса ;
k — химический эквивалент;
F — число Фарадея;
Какое же нужно напряжение на электродах для проведения процесса?
Затрачиваемая энергия: E =I x U x t
где: E –энергия;
I — сила тока;
U — напряжение на электродах;
t — время процесса;
Эта энергия затрачивается на разрядку ионов на электродах и остаётся в химической энергии полученных веществ, а часть её переходит в тепло, которое повышает температуру электролита.
Энергия источника тока, перешедшая в химическую энергию вещества: W=E-w
где w—энергия перешедшая в тепло.
Т.е. W меньше E = I x U x t
Отсюда Umin =W/ I x t
Т.о., по закону сохранения энергии, получаем минимальное напряжение при котором может происходить процесс электролиза. Оно называется «пороговым». У разных металлов, используемых в качестве электродов, различные «пороговые» напряжения. Эти различия применяются при выделении металлов в процессе электролиза, например, при извлечении чистых серебра и золота из солей меди с малыми примесями этих металлов. При прохождении тока на аноде выделяется кислород, растворяется медь а также серебро и золото, а на катоде осаждается металлическая медь.
При достаточно малом напряжении на электродах реакции растворения серебра и золота не идут и они остаются на аноде, а ионы меди осаждаются на катоде в виде металлической меди.
Серебро и золото, восстановленные в растворе, выпадают в осадок откуда и извлекаются. Выбор порогового напряжения осуществляется на основании законов Фарадея и закона сохранения энергии, а процесс электролиза показывает превращение электрической энергии в химическую, подтверждающий фундаментальный принцип превращения и сохранения энергии.

